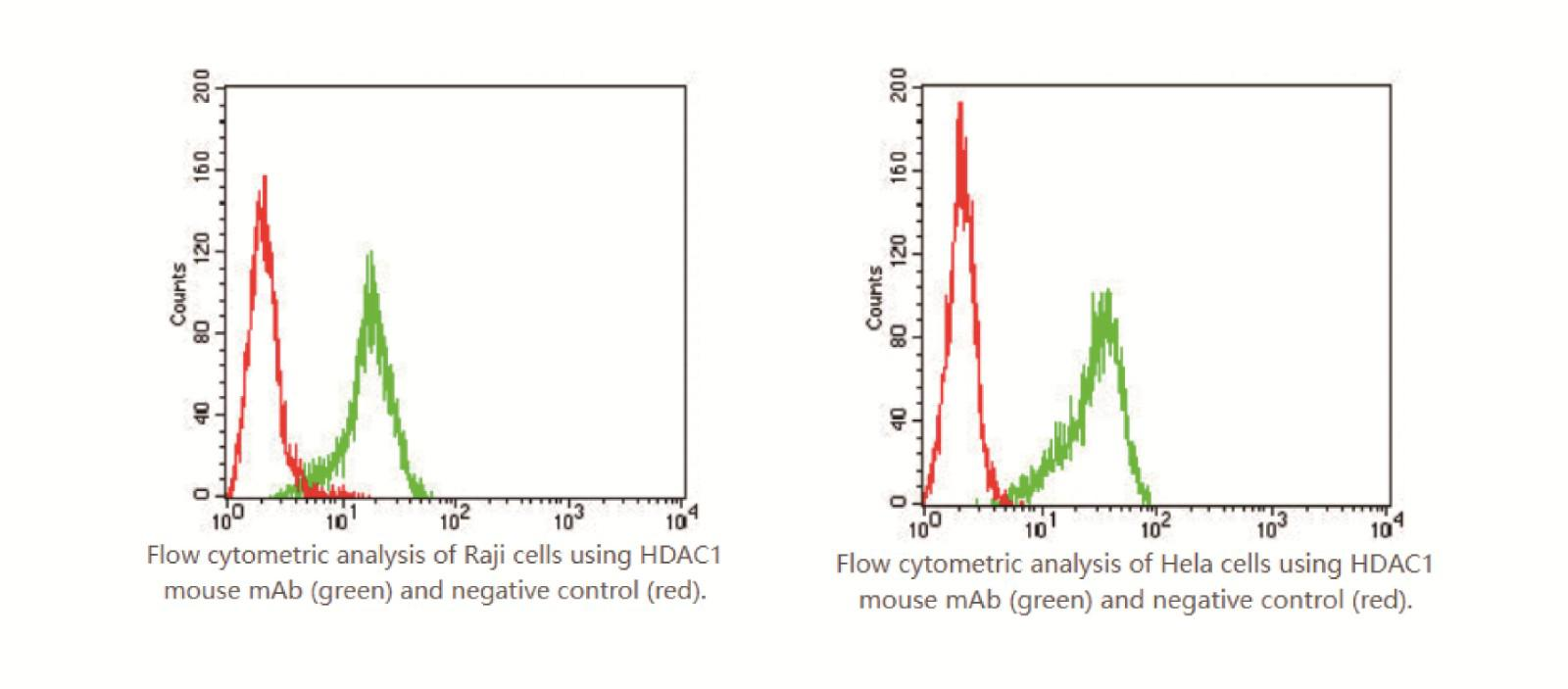
提醒成功

即用型FOB重组单抗流式细胞术方案
发布时间:2025-09-30 10:17:43流式细胞术作为一种强大的细胞分析技术,能够对单个细胞的多种特性进行快速、准确的检测与分析。在众多研究领域,其发挥着不可或缺的作用。而在即用型FOB重组单抗的检测分析中,流式细胞术的应用更是为相关研究提供了关键技术支撑。
一、实验准备
1、样本准备
细胞样本:若为悬浮细胞,以1000rmp的转速离心,收集细胞;对于贴壁细胞,使用胰蛋白酶消化后,同样以1000rmp离心收集。需确保细胞密度达到1×10⁶。
组织样本:借助胰酶或胶原酶对组织进行剪切与消化。一般而言,胰酶适用于间质较少的组织,作用时间约为20-60分钟;胶原酶则用于有胶原结构的组织,作用时间在4-48小时。在显微镜下观察,当出现单个分散细胞时,终止消化。
2、试剂准备
固定剂:常用的交联剂如4%甲醛、10%福尔马林和戊二醛,变性剂如70%乙醇和90%乙醇。若使用变性试剂固定,标记细胞内蛋白时无需再进行渗透处理;若用交联试剂固定细胞内蛋白,则需使用0.2%TritonX-100进行渗透。若目标蛋白为膜蛋白,可不进行渗透操作。
封闭液:采用10%正常山羊血清作为阻断液(需注意,其品种要与二抗一致),以减少抗体与其他非特异性蛋白质的结合。
抗体:准备即用型FOB重组单抗作为一抗,同时根据实验需求准备相应的荧光标记二抗。按照推荐的稀释比例配制抗体溶液。
3、仪器准备
开启流式细胞仪,按照仪器操作手册进行预热。检查液流系统,确保液流稳定,无气泡或堵塞现象。使用标准微球对仪器的光路和液路进行校准,保证仪器的准确性与重复性。
二、实验步骤
1、固定与渗透(若有需要)
若选择70%乙醇固定,将细胞在4℃下固定12小时,可在-20℃保存1个月;若使用4%甲醛,室温固定15分钟即可。对于细胞内蛋白标记,固定后用0.2%TritonX-100在4℃下进行渗透5分钟,处理后的样本可在4℃保存1周。若目标蛋白位于膜上,可省略固定步骤。
固定或渗透处理后,以1000rpm离心,用PBS洗涤细胞三次。
2、封闭
将细胞用10%正常山羊血清悬浮,在适宜条件下孵育一段时间,完成封闭过程,减少非特异性结合。
3、抗体孵育
按照推荐比例配制一抗溶液,将细胞与一抗在4℃孵育过夜。若实验用到正常兔或小鼠IgG,需设置阴性对照。
用PBS冲洗细胞三次,去除未结合的一抗。
在暗处按照推荐比例配制二抗溶液,将细胞与二抗在4℃孵育30分钟。
再次用PBS冲洗细胞三次,最后用500μlPBS重悬细胞,用于后续检测。
4、检测
将制备好的样本置于黑暗环境中,尽快放入流式细胞仪进行荧光信号检测。检测时,至少记录5000个活细胞,一般将细胞密度调整至1×10⁶/100μl进行流式检测。
三、实验注意事项
整个实验过程需注意无菌操作,防止样本污染,影响实验结果。
抗体孵育及样本保存过程中,要注意避光,避免荧光淬灭。
仪器操作需严格按照操作手册进行,定期对仪器进行维护和校准,确保检测结果的准确性和可靠性。
即用型FOB重组单抗流式细胞术方案为相关研究提供了一种高效、准确的检测方法。通过严谨的实验准备、规范的实验操作以及对注意事项的严格把控,能够获得可靠的实验数据,助力科研工作者在相关领域取得更深入的研究成果。












 微信/QQ登录
微信/QQ登录


 首页
首页